L’instable de la construction
Le calcium est un métal alcalino terreux que l’on ne trouve jamais à l’état pur dans la nature car trop instable. Même si c’est le cinquième élément le plus présent dans la croûte terrestre. Il va donc toujours se trouver associé à d’autres éléments qui lui procure ainsi une stabilité.
Il est ainsi souvent lié au vivant qui l’utilise dans de nombreuses applications structurelles comme le bois, en association avec la silice et du carbone, nos os ou des squelettes de plantes et d’animaux, nos dents et certainement encore bien d’autres que je ne connais pas. Les plantes grâce aux champignons l’utilisent sous forme de cation Ca++. C’est un acteur très important du vivant que l’on retrouve en quantité plus ou moins importantes dans les cendres de végétaux.
Les célèbres falaises de calcaire Normandes sont un amoncellement de squelettes d’algues microscopiques. Les coquilles des moules et de coquillages sont aussi réalisées grâce à ce métal. On le retrouve le plus souvent sous la forme CaCO3 qui est la molécule principale de la craie et des calcaires. Elle est composée d’un atome de calcium Ca + un atome de carbone C + 3 atomes d’oxygène O3.
Autant dire que ce n’est pas très difficile de trouver du calcium autour de soi sous une forme ou sous une autre.
Le calcium pendant la cuisson
Ce qu’il faut retenir, c’est qu’à 825 °C dans le four, la partie des roches ou cendres contenant du calcium vont se transformer et prendre la forme CaO, soit une molécule composée d’un atome de calcium Ca + un atome d’oxygène O. Le nom de cette molécule c’est l’oxyde de calcium que l’on appelle plus communément la chaux (chaux vive). Et c’est effectivement une molécule très vive ou active.
Cette transformation se fait avec un fort dégagement de gaz carbonique CO2.
Le cycle de la chaux
CaO c’est de la chaux vive. C’est extrêmement corrosif pour tout ce que cela touche et en particulier les métaux sous forme oxydé ou non, et c’est une molécule extrêmement instable. Cela va s’accrocher à tout ce que cela peut autour. La molécule va de toute façon chercher à retrouver une stabilité chimique par tous les moyens possibles. Impossible pour elle de rester dans cet état.
A l’air libre, c’est d’abord en attrapant la vapeur d’eau qu’elle commence sa mutation. Pour se transformer dans cette première étape en chaux hydratée Ca(OH)2 appelée aussi chaux éteinte. Mais cette molécule est elle-même vouée à évoluer. Au contact avec du gaz carbonique CO2 de l’air un processus de transformation va se mettre en place et la chaux hydratée Ca(OH)2 va se transformer à nouveau en craie CaCO3 en rejetant de la vapeur d’eau H2O.
La boucle est bouclée. Quand on chauffe une craie à 825 °C cela devient de la chaux et même si on ne fait rien, cela finit par redevenir de la craie.
On utilise ce processus depuis des milliers d’années en maçonnerie pour construire des maisons et des bâtiments dont certains ont plusieurs millénaires comme le Panthéon à Rome qui date le l’an 27 après JC. Par sa capacité à se coller chimiquement aux autres matières, la chaux hydratée est appelée en maçonnerie liant ou colle.

A est une argile locale du Sud Manche C de la chaux aérienne CL90
La chaux dans l’émail
Dans la création de l’émail, on va profiter de la phase instable de la chaux vive pendant la cuisson pour l’accrocher à d’autres matières que l’on va ainsi transformer. Ce processus d’accrochage joue sur les températures de fusions des matériaux qui sont en interaction et qui seuls fondraient à des températures beaucoup plus hautes. Le calcium et la molécule CaO se comportent alors comme un fondant.
A ce stade, je ne sais pas si au dessus de 1000 °C l’oxyde de calcium CaO va relâcher son dernier atome d’oxygène pour être pendant un court moment sous la forme pure métallique Ca.
SI vous en savez plus, merci de le partager en commentaires.
Cela va jouer aussi sur la transformation chimique de tous les oxydes métalliques autour et en particulier sur l’oxyde de fer en modifiant sa composition et ses couleurs. Les variations sont alors infinies en fonction de nombreux facteurs comme l’atmosphère de réduction ou l’ajout de valeurs d’eau.
En illustration une progression d’argile par rapport à un même volume de chaux hydratée.
Un fondant pas tous le temps
En débutant, je croyais naïvement qu’un fondant fonctionnait de façon linéaire, et que plus on en mettait plus cela fondait. Mais c’est pas du tout le cas de certains fondants comme le calcium et son proche parent le magnésium.
Il faut donc trouver une juste dose vis à vis du couple alumine silice. Trop ou pas assez de calcium et on retrouve un émail sec qui n’a pas complètement fondu. C’est ce qu’explique bien visuelement le premier diagrame des livres de Daniel De Montmollin. La fenêtre de possibles est donc assez étroite.
Point de vigilance
Quand la chaux s’hydrate, elle gonfle. Elle prend du volume. Et cela a un effet très concret sur les émaux mal mélangés ou mal broyés dans lesquels il resteraient à la pose des petits bouts de calcaire, de coquille ou de craie. A la sortie du four on voit d’abord de petites inclusions blanches qui n’ont pas fondu dans l’émail. Puis quelques jours après, l’émail au-dessus de l’inclusion éclate sous la pression de la chaux qui gonfle. Il faut donc être vigilant sur ce point en particulier avec les matières de rencontre qui sont composées de calcium.




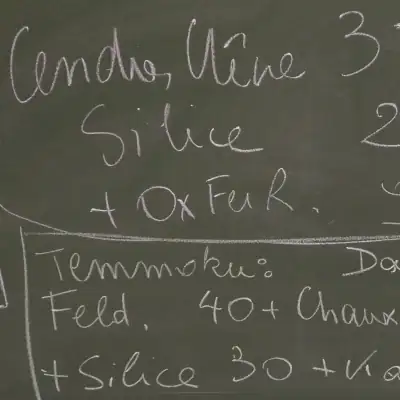
0 commentaires